抗体药物坐褥是个十分繁杂的经过,大致分为上游的发酵及下游的折柳纯化:上游工艺紧要蕴涵细胞苏醒、传代、发酵坐褥。而下游工艺紧要蕴涵膜过滤及多步层析折柳纯化。过去十多年来,基因工程获取突飞大进的先进,细胞培植的表达量从从来的不到
到现正在广大到达5g/L,有的乃至超越10g/L。这些先进是由细胞表达载体的开垦,克隆筛选以及细胞培植基优化等身手革新所驱动的。因为发酵产率的大幅度晋升,使得上游细胞培植本钱大幅度低落,下表是抗体坐褥本钱与表达量的干系。表
下游工艺正在全豹生物造药坐褥中吞噬60%以上坐褥本钱,也被以为是最须要刷新的身手规模。下游工艺先辈性决意了药品的质料,及药品坐褥效力和本钱,也成为生物造药企业的主旨比赛力所正在。因为生物分子因为布局繁杂,对表部前提敏锐,平静性差,杂质多,浓度低等特征,且囚禁部分对生物药的纯度和质料请求越来越高。因而下游的折柳纯化成为生物造药的瓶颈,也是生物造药本钱最大的一块。层析身手因为拥有折柳纯化效力高,前提温和且容易坚持对象分子的生物活性,因而层析是生物造药折柳纯化最紧要措施。
”——令人爱恨交加的Protein A生物大分子的层析措施紧要分为亲和,离子换取,疏水感化及体积排阻
亲和层析是诈骗介质上的配基与对象卵白分子有特异性集合,而对其它的卵白质及杂质不吸附,因而杂质从层析柱中流出,被吸附的对象生物分子通过转折洗脱液的前提使被折柳物质与配基解吸附,即可到达折柳纯化的主意。亲和层析无疑是最理念的层析折柳措施,其与其它折柳措施如离子换取、疏水、体积排阻等最大的差异是因为亲和层析只与对象生物分子爆发静心性吸附,其它杂质都不吸附,因而亲和层析折柳纯化的工艺前提与杂质的构成及含量多少干系不大,从而大大简化亲和折柳工艺开垦措施,而其它折柳措施如离子换取、疏水、体积排阻等都是基于对象分子跟杂质分子之间的巨细,电荷及疏水强度的差别来折柳的,因而假使折柳纯化同样的对象分子,但差异样品的杂质组分差异,含量差异,纯化工艺措施就须要从新调节。
极大地降低了抗体的折柳纯化效力,毫无疑义Protein A亲和介质是层析介质的皇冠上的明珠,其价钱也是一般层析介质的十几倍。Protein A亲和层析介质之以是会成为层析介质的贵族与它匹敌体有特异性吸附相合。Protein A亲和层析是诈骗Protein A配基与对象抗体拥有静心亲和吸附感化从而到达折柳纯化抗体的主意。由于配基与对象抗体的感化的静心性,其折柳纯化与对象样品抗体纯度无合,也与样品杂质含量和品种多少无合,利用Protein A填料一步纯化对象抗体就能够到达95%纯度以上,接管率到达90%以上。Protein A层析介质的显露,让抗体的折柳纯化次序及措施大大简化,使得抗体的折柳纯化比其布局容易多的生物分子都要容易。抗体折柳纯化根基都是尺度化的三步曲,第一步用Protein A举行抗体捉拿,第二步用阳离子去除多聚体,第三步用阴离子精纯去除糟粕少量杂质。
A亲和层析仍旧成为平台化身手,被普及运用正在抗体类分子捉拿阶段。ProteinA与抗体分子之间可特异性集合,特地对IgG1、IgG2、IgG4有较强亲和感化,使得抗体分子与发酵液中不具FC端布局的杂质如宿主卵白与核酸等有用折柳,进而到达纯化主意。亲和特异性付与了ProteinA填料捉拿时可承担更广泛的样品前提,如pH及电导率等。因而,发酵液通过离心、深层过滤后即可直接举行亲和捉拿。其余与离子换取、疏水层析等措施比拟,Protein A亲和层析纯化抗体料液能够获取更大的纯度,一步就能够获取抗体纯度大于98%,况且正在接管率上也有显明上风,亲和捉拿接管率可达95%。
Protein A是爱恨交加,爱的是Protein A亲和层析的显露大大简化抗体的折柳纯化工艺开垦,并大幅度降低抗体纯化效力和纯度,况且简直实用于统统抗体的折柳纯化。恨的是Protein A亲和介质价钱贵,寿命短,吞噬下游折柳纯化成紧要本。固然许多科学家一经努力于探究新的价廉抗体亲和配基以庖代高贵的Protein A亲和配基,但都没有告捷找到一个能够庖代Protein A配基的分子。Protein A亲和层析因其高度特异性及同时拥有浓缩的效率成为过去近30年里抗体纯化捉拿的金尺度。Protein A
Protein A卵白配基本钱远比古板的幼分子配基高贵,另一方面,Protein A亲和填料寿命较短也是其本钱过高的紧要要素。大凡离子换取填料利用寿命可高达1000次,而亲和填料寿命大凡正在100-200次。另有Protein A介质贵与其从来处于高度垄断的事态也相干系,因而Protein A亲和层析介质国产化以低落抗体的坐褥本钱是势必的兴盛趋向。
细胞壁锚钉卵白,其C端为细胞壁集合区域,抗体集合区域蕴涵五个同源区域(E、D、A、B、C,N端纪律)。五个domain的序列同源率65-90%(图1)。
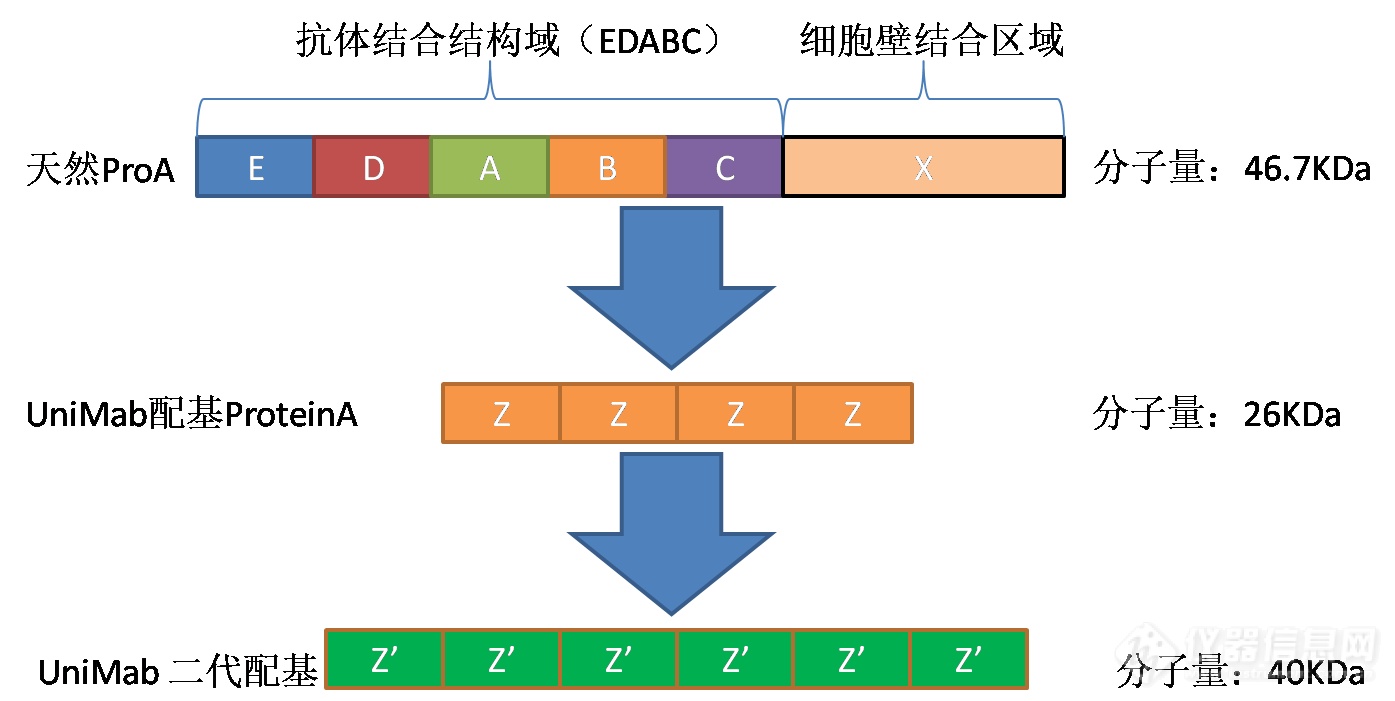
端CH2-CH3区域与ProteinA卵白B布局域上两条反相平行的α螺旋布局互相集合。抗体与ProteinA集应时,紧要依附的是疏水感化力,其次是氢键和双盐桥感化力。疏水感化紧要来自于主旨区域组氨酸残基。抗体上高度落后|后进的组氨酸残基与ProteinA上的组氨酸残基爆发互相感化。碱性或中性前提下,组氨酸残基不带电荷,其咪唑环的疏水效应的巩固推进了FC端与ProteinA的集合。当pH低落至4.5以下时,组氨酸带上正电荷,于是两者形成静电排斥力,抗体从ProteinA上解离。除FC端恒定区域表,可变区VH3也参预了ProteinA集合及洗脱,影响洗脱pH(图2)。
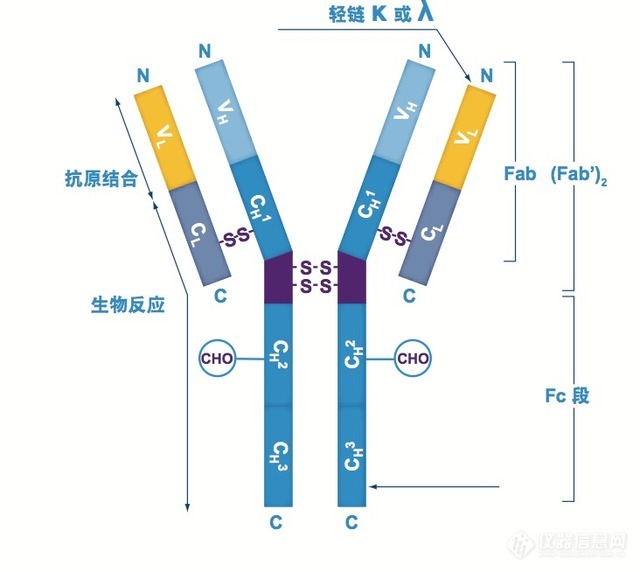
5个能够和抗体IgG分子Fc段特异性集合的布局域,当其举动亲和配基被偶联到填料基质上后,可特异性地与样品中的抗体分子集合,使其他杂卵白流穿,借帮高效亲和层析仅需一步就可使对象抗体纯度超越95%,其它Protein A也可集合另少许免疫球卵白,如可用于某些种属IgA、IgM的纯化。因为Protein A亲和层析基于自然存正在的生物大分子之间特异性集合为折柳机理,这种得天独厚的势使得Protein A亲和层析成为重组卵白\抗体等折柳纯化中的绝佳挑选(图3)。下一期,江必旺博士将不绝分享
